
- Autors Stanley Ellington [email protected].
- Public 2023-12-16 00:20.
- Pēdējoreiz modificēts 2025-01-22 16:05.
ICH E2A KLĪNISKĀS DROŠĪBAS DATU PĀRVALDĪBA: DEFINĪCIJAS UN STANDARTI ĀTRĀ ZIŅOŠANAI. Tajā ir arī sniegti norādījumi par mehānismiem, kā rīkoties ar paātrinātu (ātru) ziņošanu par zāļu blakusparādībām zāļu izstrādes izpētes fāzē.
Kas ir ICH e2d?
E2D Drošības datu pārvaldība pēc apstiprināšanas: definīcijas un standarti paātrinātai ziņošanai. The ICH Saskaņotās pamatnostādnes tika pabeigtas 2003. gada novembrī 4. solī. Šis dokuments nodrošina standartizētu procedūru drošības datu pārvaldībai pēc apstiprināšanas un norādījumus informācijas vākšanai un ziņošanai.
Turklāt, kas ir paātrinātais drošības ziņojums? Atsevišķi nopietnu, negaidītu ADR gadījumi. Ir pakļautas visām zāļu blakusparādībām (ADR), kas ir gan nopietnas, gan negaidītas paātrināta ziņošana . Tas attiecas uz ziņojumus no spontāniem avotiem un no jebkāda veida klīniskas vai epidemioloģiskās izmeklēšanas neatkarīgi no projekta vai mērķa.
Vienkārši tā, kādas ir ICH vadlīnijas?
ICH (Pilna forma = Starptautiskā saskaņošanas konference) ir komiteja, kas nodrošina farmaceitisko stabilitāti vadlīnijas nozarēm. ICH stabilitāti vadlīnijas Visā pasaulē tiek ievēroti stabilitātes apstākļi un produktu kvalitātes testēšana.
Kad būtu jāziņo sponsoram par nenopietnām nevēlamām blakusparādībām?
Saistīts un negaidīts letāls vai dzīvībai bīstams AE (4. vai 5. smaguma pakāpe), kas saistīti ar zāļu lietošanu obligāti būt ziņots FDA pa tālruni vai faksu Nē vēlāk kā 7 kalendārās dienas pēc sponsors pirmo reizi uzzina par notikumu.
Ieteicams:
Kas ir globalizācija, kas raksturo tirgu globalizācijas jēdzienu?
Globalizāciju kā sarežģītu un daudzpusīgu parādību daži uzskata par kapitālistiskas ekspansijas veidu, kas ietver vietējās un nacionālās ekonomikas integrāciju globālā, neregulētā tirgus ekonomikā. Līdz ar globālās mijiedarbības pieaugumu pieaug starptautiskā tirdzniecība, idejas un kultūra
Kas ir konkurenti, kā konkurējošā sāncensība ir konkurētspējīga uzvedība un konkurences dinamika, kas definēta 5. nodaļā?
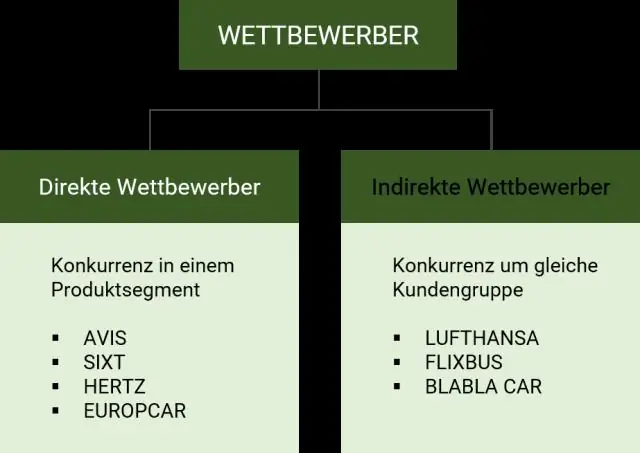
Konkurences sāncensība attiecas uz notiekošajām darbībām un reakcijām starp uzņēmumu un tā TIEŠajiem KONKURENTIEM par izdevīgu tirgus pozīciju. Konkurences dinamika attiecas uz notiekošajām darbībām un atbildēm STARP VISIEM UZŅĒMUMIEM, kas konkurē tirgū par izdevīgām pozīcijām
Kas ir uzņēmums, kas pieder un kuru pārvalda privātpersona?

Individuālais uzņēmums. Uzņēmums, kas pieder vienai personai un to pārvalda
Kas ir ICH stabilitātes pārbaude?
Farmaceitiskās stabilitātes testēšanas datu vākšana par zālēm vai zāļu vielām, lai noteiktu vispārējo stabilitātes profilu, ir nepieciešams solis zāļu apstiprināšanas procesā. Ir jānovērtē zāļu vielas, zāļu produkta, kombinēto ierīču un izejvielu stabilitāte
Kas ir ICH pētījums?

Starptautiskā cilvēkiem paredzēto farmaceitisko izstrādājumu tehnisko prasību saskaņošanas padome (ICH) ir unikāla, apvienojot regulatīvās iestādes un farmācijas nozari, lai apspriestu zāļu reģistrācijas zinātniskos un tehniskos aspektus
