
- Autors Stanley Ellington [email protected].
- Public 2023-12-16 00:20.
- Pēdējoreiz modificēts 2025-01-22 16:06.
Klīnisko pētījumu pieteikums ( CTA ) ir pieteikums/iesniegums kompetentajam valstspiederīgajam. Regulējošais Iestāde(-as), kas atļauj(-as) veikt klīnisko izpēti konkrētā valstī. Piemēri. iesniegumus kompetentajai valsts iestādei Regulējošais Iestādes var ietvert, bet ne tikai: 1.
Saistībā ar to, kas ir CTA klīniskajos pētījumos?
A Klīniskais pētījums Līgums ( CTA ) ir juridiski saistošs līgums, kas pārvalda attiecības starp sponsoru, kurš, iespējams, nodrošina pētījums zāles vai ierīces, finansiālais atbalsts un/vai patentēta informācija un iestāde, kas var sniegt datus un/vai rezultātus, publicēšana, ievade
Līdzīgi, kurš apstiprina klīniskos izmēģinājumus Apvienotajā Karalistē? Tiesas process autorizācija Visas klīniskie pētījumi zālēm un pētījumiem par medicīnas ierīcēm ir jāsaņem atļauja no organizācijas, ko sauc par Zāļu un veselības aprūpes produktu regulatīvo aģentūru (MHRA). To sauc Klīniskais pētījums Autorizācija (CTA).
Pēc tam rodas jautājums, kas ir CTA farmācijā?
Klīnisko izmēģinājumu apstiprinājumi ( CTA ); (IND) Procedūra ietver EudraCT numura iegūšanu no Eiropas Zāļu aģentūras (EMA) un klīniskās izpētes atļaujas pieteikuma iesniegšanu ( CTA ) katras dalībvalsts, kurā tiks veikta pārbaude, kompetentajai iestādei.
Vai Inds ir apstiprināts?
IND nav mārketinga lietojumprogramma apstiprinājums . Tas ir ceļš, pa kuru sponsors no Pārtikas un zāļu pārvaldes (FDA) saņem atbrīvojumu no federālā likuma, kas aizliedz neapstiprinātu zāļu transportēšanu pāri valsts robežām.
Ieteicams:
Kas ir globalizācija, kas raksturo tirgu globalizācijas jēdzienu?
Globalizāciju kā sarežģītu un daudzpusīgu parādību daži uzskata par kapitālistiskas ekspansijas veidu, kas ietver vietējās un nacionālās ekonomikas integrāciju globālā, neregulētā tirgus ekonomikā. Līdz ar globālās mijiedarbības pieaugumu pieaug starptautiskā tirdzniecība, idejas un kultūra
Kas ir konkurenti, kā konkurējošā sāncensība ir konkurētspējīga uzvedība un konkurences dinamika, kas definēta 5. nodaļā?
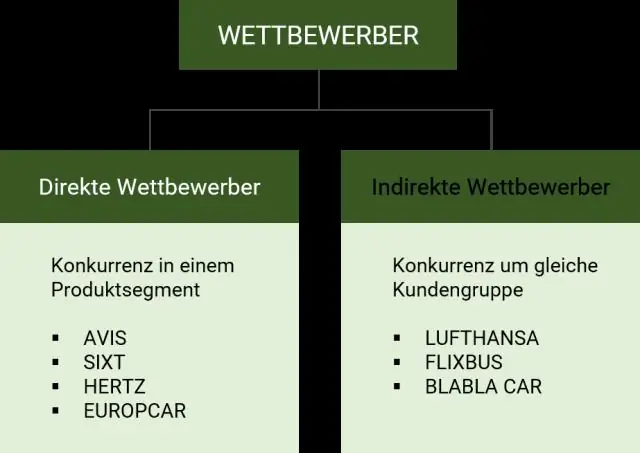
Konkurences sāncensība attiecas uz notiekošajām darbībām un reakcijām starp uzņēmumu un tā TIEŠajiem KONKURENTIEM par izdevīgu tirgus pozīciju. Konkurences dinamika attiecas uz notiekošajām darbībām un atbildēm STARP VISIEM UZŅĒMUMIEM, kas konkurē tirgū par izdevīgām pozīcijām
Kas ir uzņēmums, kas pieder un kuru pārvalda privātpersona?

Individuālais uzņēmums. Uzņēmums, kas pieder vienai personai un to pārvalda
Kas ir CTA farmācijā?

Klīnisko izmēģinājumu apstiprinājumi (CTA); (IND) Procedūra ietver EudraCT numura iegūšanu no Eiropas Zāļu aģentūras (EMA) un klīniskās izpētes atļaujas (CTA) pieteikuma iesniegšanu katras dalībvalsts, kurā tiks veikts pētījums, kompetentajai iestādei
Kādas ir reālas tiesības Dienvidāfrikas tiesību aktos?

Reālas tiesības ir apgrūtināt īpašumu, nevis īpašnieka īpašumtiesības. Dienvidāfrikas tiesību aktos ir arī strīdīgs jautājums, vai nekustamais īpašums var būt res nullius. Turklāt “jaunās” īpašumtiesības sākotnējās īpašumtiesību iegūšanas gadījumā netiek iegūtas vai izmantotas attiecībā uz res nullius
